

江苏省麻醉学重点实验室王午阳教授课题组长期从事离子通道的生理、病理功能研究,以阐述离子通道信号调控机制与疾病的关系为目标,致力于解析离子通道调控肿瘤、神经系统疾病等疾病的分子机理。在2021年内,该课题组研究成果先后发表于Top期刊《Autophagy》(年度内连续2次发表)和《Cancer Letters》。
自噬是进化上保守的、由溶酶体介导的生物降解过程,对细胞内稳态具有重要的调控作用,细胞自噬也参与调节多种疾病的病理进程。江苏省麻醉学重点实验室、江苏省麻醉与镇痛应用技术重点实验室、国家药品监督管理局麻醉与精神药物研究与评价重点实验室王午阳教授课题组长期从事“自噬与肿瘤、神经系统疾病”研究。该课题组首次发现存在于溶酶体膜上的一种非选择性阳离子通道—TRPML1(基因名:MCOLN1),通过调控溶酶体中的锌离子释放,特异性地抑制肿瘤细胞的自噬活动。该工作以“MCOLN1/TRPML1 finely controls oncogenic autophagy in cancer by mediating zinc influx”为题发表在著名国际期刊《Autophagy》(中科院1区,top期刊) (https://doi.org/10.1080/15548627.2021.1917132)。在该项工作基础上,该团队进一步解析了TRPML1介导的自噬抑制通过限制线粒体更新,激活ROS/p53/转移相关的靶基因的信号通路,从而实现对于黑色素瘤转移抑制的分子机制。此研究不仅系统阐明了肿瘤细胞的自噬活动调控p53信号通路的分子机制,并且动物实验结果验证了通过靶向激活TRPML1通道抑制肿瘤细胞自噬活动,可以有效地抑制小鼠黑色素瘤的转移。这一最新研究成果再次发表在《Autophagy》杂志上。(https://doi.org/10.1080/15548627.2021.2008752)。该团队还发现激活另一种存在于富含锌离子细胞器上的TRPM7离子通道,同样可以通过调控其对于锌离子的释放,抑制肿瘤细胞的自噬活动。靶向激活TRPM7离子通道,亦有效阻止小鼠异种移植人源黑色素瘤的生长及转移,佐证锌离子流对于肿瘤细胞自噬活动的调控作用, 该研究结果以“Stimulating TRPM7 suppresses cancer cell proliferation and metastasis by inhibiting autophagy“ 为题,发表在(Cancer Lett. 2022. Jan 28;525:179-197)(https://doi.org/10.1016/j.canlet.2021.10.043)。王午阳教授课题组的这一系列研究为临床治疗黑色素瘤转移提供了新的靶点。
该研究是江苏省麻醉学重点实验室邢燕红博士、南通大学第二附属医院韦香庆医师、徐州医科大学2018级麻醉学本科生刘宇程、中国医科大学盛京医院王萌萌副主任医师等在王午阳教授的指导下完成的,戴尔豪斯大学齐剑崧研究员共同参与了该研究指导工作。该系列研究得到国家自然基金、江苏省特聘教授计划和徐州医科大学创新团队等项目资助。
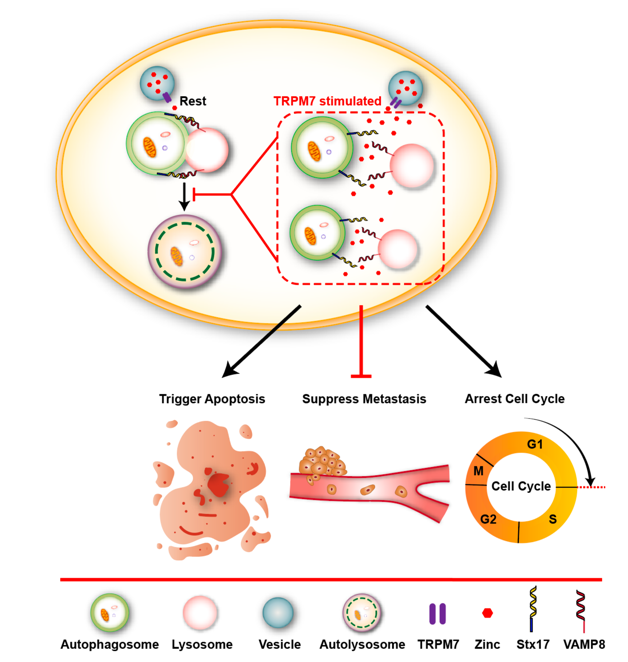
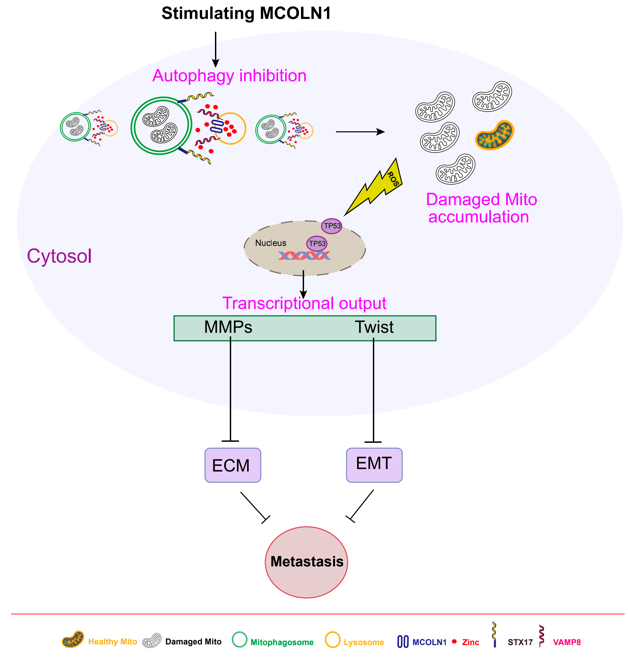
(图:TRPML1、TRPM7通道分别通过调控自噬,抑制肿瘤细胞生长、转移的分子机制)